歡迎訪問蘇州安峰環(huán)保科技有限公司官網(wǎng)

土壤被污染后呈現(xiàn)酸化趨勢,各項指標特點有哪些?酸化土壤對生態(tài)有哪些危害呢?民眾對土壤酸化知識了解不多,今天就酸化土壤問題提出幾點小常識,對土壤的基陽離子、活性鋁、銨態(tài)氮肥等概念進行清晰的梳理。
1、土壤中的鹽基陽離子不是堿
土壤中的鹽基陽離子指正二價的鈣和鎂及正一價的鉀和鈉(Ca2+、Mg2+、K+、Na+),它們大部分通過靜電吸引作用吸附于土壤固相表面,這也使得帶負電荷的土壤表面保持電中性狀態(tài),這部分鹽基陽離子稱為交換性鹽基陽離子。小部分鹽基陽離子存在于土壤溶液中,使鹽基陽離子在固/液之間保持吸附與解吸平衡。多雨條件下,土壤溶液中的鹽基陽離子會隨地表徑流流失或沿土壤剖面向下遷移進入地下水。這一過程打破了鹽基陽離子在固/液相之間的吸附-解吸平衡,原先吸附在土壤固相表面的部分交換性鹽基陽離子釋放到土壤溶液中,空缺的吸附位(也叫陽離子交換位)被氫離子(H+)占據(jù),產(chǎn)生交換性H+,土壤發(fā)生酸化(圖1)。因此,有人認為鹽基陽離子是“堿”,土壤中這部分堿性物質(zhì)的淋失導致了土壤酸化。這種認識是不正確的。
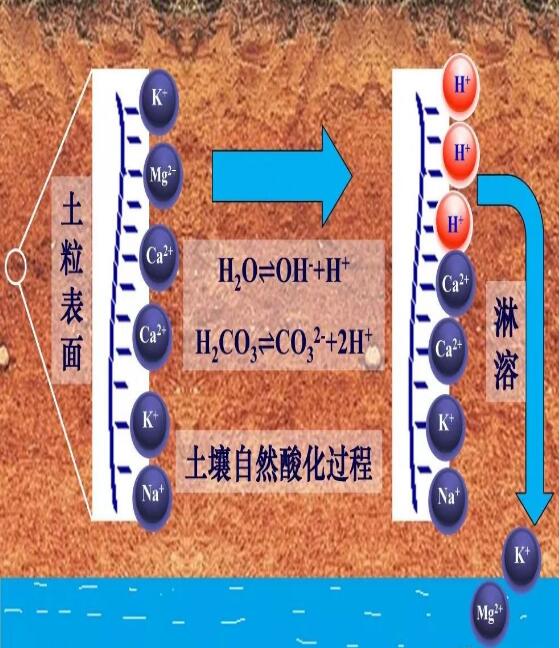
圖1:土壤中交換性鹽基陽離子淋失和交換性H+的產(chǎn)生過程示意圖
按照廣義酸堿理論,包括鹽基陽離子在內(nèi)的所有陽離子都是酸,只不過鹽基陽離子是非常弱的酸。常見的陽離子如Al3+、Fe3+、NH4+及重金屬陽離子呈明顯的酸性。為了進一步理解鹽基陽離子的酸堿性,我們舉例來說明。氫氧化鈉(NaOH)和氫氧化鉀(KOH)是常見的強堿,它們?nèi)芙庠谒型耆x解為氫氧根(OH-)、K+和Na+。當發(fā)生酸堿中和反應時,OH-與H+結(jié)合形成H2O。如果K+和Na+是堿,那么H+應該與K+和Na+發(fā)生中和反應,那OH-干什么呢?很顯然,在這2種強堿中,OH-是堿,K+和Na+是與堿配對的陽離子。鹽基陽離子的英文單詞是Basecations,這是導致部分人產(chǎn)生錯誤認識的原因。但這個英文詞組不應該翻譯為堿性陽離子,而應該理解為堿基陽離子,意思是與堿配對的陽離子。
2、土壤中的酸主要以活性鋁的形態(tài)存在于固相部分
當外源H+進入土壤,如果土壤固相含碳酸鹽,H+將優(yōu)先與碳酸鹽反應而消耗掉,土壤pH下降會很慢;但如果H+進入酸性土壤,H+將與土壤交換性鹽基陽離子發(fā)生離子交換反應,釋放部分交換性鹽基陽離子到土壤溶液中,同時產(chǎn)生交換性H+。由于H+的反應活性很高,交換性H+不穩(wěn)定,這部分H+的大部分會與土壤粘土礦物反應,釋放土壤鋁硅酸鹽礦物結(jié)構(gòu)中的鋁,并產(chǎn)生交換性Al3+。交換性鋁與交換性H+的總和為交換性酸,當達到反應平衡時,土壤的交換性酸主要以交換性鋁存在(圖2)。在有機質(zhì)含量很低的強酸性礦質(zhì)土壤中,交換性鋁占交換性酸的比例達95%以上。因此,土壤發(fā)生酸化后土壤中的絕大部分酸以交換性鋁的形態(tài)存在于土壤固相部分,僅有一小部分酸存在于土壤溶液中。前者稱為土壤潛性酸度,后者稱為活性酸度。
土壤酸度通常用土壤pH來表示,土壤pH一般用pH電極測定,它的數(shù)值為土壤溶液中H+活度的負對數(shù)值,因此土壤pH變化1個單位,H+活度變化10倍。土壤潛性酸度與活性酸度之間保持平衡關(guān)系,主要通過少量交換性鋁的釋放、溶液中Al3+的水解與H+的產(chǎn)生為紐帶(圖2)。雖然土壤pH表示土壤活性酸度,它仍可反映土壤酸性的強弱程度,但不能表示土壤酸的數(shù)量。
土壤酸化后大量酸累積在土壤固相部分,中和這部分酸比中和溶液中的活性酸所需石灰等堿性物質(zhì)的數(shù)量要多得多。而且潛性酸主要以交換性鋁存在,它與堿的反應速度比H+慢得多。因此,土壤酸化后其改良難度很大,保護土壤,阻控酸化是我們的重要職責。

圖2:交換性H+轉(zhuǎn)化為交換性鋁及交換性鋁釋放、水解和產(chǎn)H+的過程示意圖
3、銨態(tài)氮肥即使全部被植物吸收也會酸化土壤
人為活動加速土壤酸化的致酸源主要有2個方面:酸沉降和不當?shù)霓r(nóng)業(yè)措施。酸沉降的影響比較容易理解,它將酸直接輸入土壤中。農(nóng)業(yè)措施中施用銨態(tài)氮肥是加速土壤酸化的主要原因。銨態(tài)氮肥對土壤酸化影響的大小涉及銨態(tài)氮的硝化反應、作物對氮素的吸收以及氮的淋溶損失等幾個方面。先以硝酸銨(NH4NO3)為例說明作物吸收的影響,如果施入土壤中的NH4NO3全部被作物吸收利用,它對土壤酸化沒有影響。但大多數(shù)植物對陽離子的吸收量多于陰離子,如果植物吸收的銨離子(NH4+)多于硝酸根(NO3-),植物為了維持體內(nèi)的電荷平衡,會通過根系釋放H+到土壤中,酸化土壤。由于硝酸銨是受管制的化學品,目前常用的氮肥是尿素、硫酸銨和氯化銨。尿素在土壤中還涉及水解反應,本文不作討論。由于作物對硫酸根和氯離子的吸收量低于硝酸根,因此單從作物吸收角度,這2種氮肥施用后對土壤的酸化作用也大于硝酸銨。
銨態(tài)氮肥施入土壤后會很快發(fā)生硝化反應,其方程式為:NH4++2O2=2H++NO3-+H2O。可以看出,1份銨離子經(jīng)硝化反應產(chǎn)生1份硝酸根和2份H+,如果硝化產(chǎn)生的硝酸根全部被植物吸收,植物根系會釋放等比例的OH-,中和掉1半的H+,另一半H+留在土壤中。但如果硝化產(chǎn)生的硝酸根隨降雨淋失掉,那么2份H+均留在土壤中,酸化土壤。正如上文所說,H+的反應活性高,一旦產(chǎn)生會很快與土壤發(fā)生反應,它隨降雨的淋失很少。而硝酸根為陰離子,帶負電荷的土壤表面對其的靜電排斥作用使它很容易從土壤中淋失。
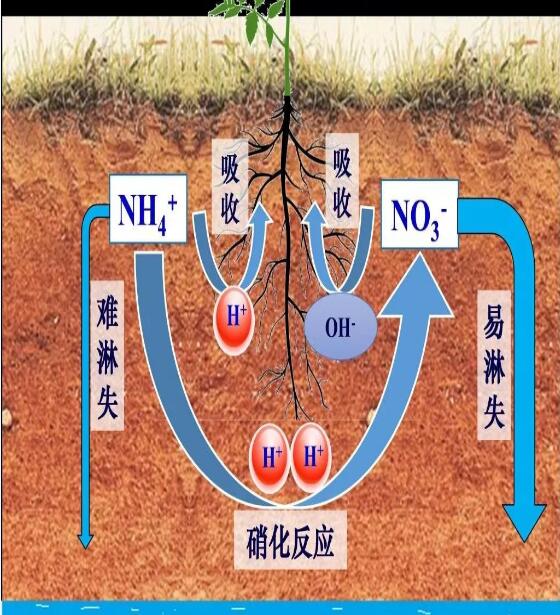
圖3:植物對銨態(tài)氮和硝態(tài)氮的吸收、硝化反應、硝態(tài)氮淋失與土壤酸化關(guān)系示意圖
根據(jù)上述分析,施用銨態(tài)氮肥將不可避免地引起土壤酸化,但采取合理的管理措施,適當降低化學氮肥的施用量,提高氮肥的利用率,減少氮肥的淋溶損失,可以將其對土壤酸化的影響降至最小程度。
土壤酸化后對整個農(nóng)業(yè)和生態(tài)系統(tǒng)危害比較大,當土壤PH值達到5.5以上時對植物生長就不利,對于弱酸的土壤采用施肥的方法進行管理后,可以調(diào)節(jié)土壤酸堿度,對整個農(nóng)業(yè)生產(chǎn)非常有利。但是如果已經(jīng)酸化的土壤是禁止種植農(nóng)作物的,人類食用被污染土壤生產(chǎn)的糧食,容易對人體造成危害影響健康。